Сфокусированный ультразвук высокой интенсивности - High-intensity focused ultrasound
Эта статья содержит контент, который написан как Реклама. (Январь 2015) (Узнайте, как и когда удалить этот шаблон сообщения) |
| Сфокусированный ультразвук высокой интенсивности | |
|---|---|
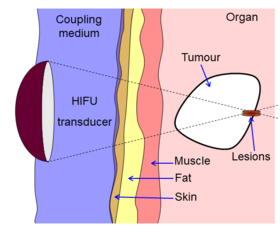 Схема, показывающая, как HIFU можно использовать для разрушения тканей в организме. Акустическая линза используется для фокусировки звука в небольшой точке тела. Звук распространяется через многие слои тканей. Из-за усиления фокуса разрушается только ткань в фокусе. | |
| Другие имена | Фокусированная ультразвуковая хирургия под магнитным резонансом (MRgFUS), Фокусированная ультразвуковая хирургия (FUS) |
Сфокусированный ультразвук высокой интенсивности (HIFU) это неинвазивный терапевтическая техника[1] который использует неионизирующие ультразвуковые волны для нагрева или абляции ткани. HIFU можно использовать для увеличения поток крови или лимфы, или разрушить ткань, например опухоли, через термические и механические механизмы. Учитывая распространенность и относительно низкую стоимость ультразвука, HIFU является предметом многочисленных исследований и разработок. Предпосылка HIFU заключается в том, что это неинвазивная недорогая терапия, которая может как минимум превзойти существующие стандарты лечения.
Технология аналогична ультразвуковая визуализация, хотя для достижения необходимых тепловых доз используются более низкие частоты и непрерывные, а не импульсные волны. Однако импульсные волны также могут использоваться, если механический а не термическое повреждение. Акустические линзы часто используются для достижения необходимого интенсивность в целевой ткани, не повреждая окружающие ткани. Аналогия - использование увеличительного стекла для фокусировки солнечного света; только фокус увеличительного стекла имеет высокую интенсивность. Хотя линзы традиционно использовались, фазированные решетки становятся все более распространенными, поскольку они позволяют легко изменять положение фокуса.
HIFU традиционно сочетается с другими методы визуализации Такие как медицинский ультразвук или же МРТ для обеспечения руководства лечением и мониторинга.
История
Эта секция нужны дополнительные цитаты для проверка. (Апрель 2016 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
О первых исследованиях HIFU для неинвазивной аблации сообщили Lynn et al. в начале 1940-х гг. Обширные важные ранние работы были выполнены в 1950-х и 1960-х годах Уильямом Фраем и Фрэнсисом Фрай в Университете Иллинойса.[2] и Карл Таунсенд, Ховард Уайт и Джордж Гарднер из Международного научно-исследовательского института в Шампейне, штат Иллинойс, кульминацией которых стало клиническое лечение неврологических расстройств. В частности, ультразвуковая визуализация высокой интенсивности и ультразвуковая визуализация выполнялись стереотаксически с помощью прецизионного фрезерного станка Цинциннати для точной абляции опухолей головного мозга. До недавнего времени клинических испытаний HIFU для абляции было немного (хотя значительная работа по гипертермии проводилась с ультразвуковым нагревом), возможно, из-за сложности лечения и сложности неинвазивного нацеливания луча. С недавними достижениями в области медицинской визуализации и ультразвуковых технологий интерес к HIFU-абляции опухолей возрос.
Первый коммерческий аппарат HIFU, названный Sonablate 200, был разработан американской компанией Focus Surgery, Inc. (Милипитас, Калифорния) и запущен в Европе в 1994 году после получения сертификата CE, что принесло первую медицинскую валидацию технологии для лечения доброкачественной гиперплазии простаты. (ДГПЖ). Комплексные исследования, проведенные практикующими врачами в более чем одном месте с использованием устройства, продемонстрировали клиническую эффективность для разрушения ткани простаты без потери крови или долгосрочных побочных эффектов. Более поздние исследования локализованного рака простаты, проведенные Мюратом и его коллегами в больнице Эдуарда Эррио в Лионе в 2006 году, показали, что после лечения с помощью Ablatherm (EDAP TMS, Лион, Франция) выживаемость без прогрессирования очень высока для пациентов с низким и средним риском пациенты с рецидивирующим раком простаты (70% и 50% соответственно)[3] HIFU-лечение рака простаты в настоящее время[когда? ] одобренная терапия в Европе[требуется разъяснение ], Канада, Южная Корея, Австралия и другие страны.[нужна цитата ] По состоянию на 2012 год[Обновить], клинические испытания Sonablate 500 в Соединенных Штатах продолжаются для пациентов с раком простаты и тех, у кого была лучевая недостаточность.[4]
Использование сфокусированного ультразвука с магнитным резонансом было впервые упомянуто и запатентовано в 1992 году.[5][6] Позже эта технология была передана InsighTec в Хайфе, Израиль, в 1998 году. InsighTec ExAblate 2000 была первой системой MRgFUS, получившей одобрение FDA на рынке.[7] В Соединенных Штатах.
Медицинское использование
Эта секция нужно больше медицинские справки за проверка или слишком сильно полагается на основные источники. (Апрель 2016 г.) |
Нет четкого консенсуса относительно границ между HIFU и другими формами терапевтический ультразвук. В академической литературе HIFU обычно относится к высоким уровням энергии, необходимой для разрушения ткани через абляция или же кавитация, хотя он также иногда используется для описания приложений с меньшей интенсивностью, таких как трудотерапия и физиотерапия.
В любом случае, HIFU используется для неинвазивного нагрева ткани глубоко в теле без необходимости делать разрез.[1] Основное применение - разрушение тканей, увеличение перфузии и физиотерапия. Использование ультразвука при лечении опорно-двигательного аппарата является еще одним использование в условиях физиотерапии.[8]
Неврологические расстройства
Одним из первых применений HIFU было лечение болезни Паркинсона в 1940-х годах. Хотя в то время HIFU был неэффективен, он способен вызывать патологию. Сфокусированная ультразвуковая система одобрена в Израиле, Канаде, Европе, Корее и России для лечения эссенциальный тремор,[9] невропатическая боль,[10] и Паркинсонический тремор.[11] Такой подход позволяет лечить мозг без разреза или облучения. В 2016 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA ) одобрила систему Insightec Exablate для лечения эссенциального тремора.[12] Лечение других таламокортикальные аритмии психиатрические заболевания находятся в стадии расследования.[13]
Аденомиоз матки и миома
Лечение симптоматического миома матки стала первым одобренным приложением HIFU Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в октябре 2004 г.[7] Исследования показали, что HIFU безопасен и эффективен, и что у пациентов сохраняется стойкое облегчение симптомов в течение как минимум двух лет без риска осложнений, связанных с хирургическим вмешательством или другими более инвазивными подходами.[14] Дополнительное лечение потребуется до 16-20% пациентов.[15]
Рак
HIFU - привлекательный вариант для опухолей в труднодоступных или неоперабельных местах.[16] Особый интерес представляют рак кишечника и рак мозга. Рекомендуя лечение, врач должен взвесить
Рак простаты
HIFU изучается у мужчин с рак простаты.[17][18] HIFU был одобрен в США для абляции ткани простаты в 2015 году.[19][20][21] HIFU также используется для удаления рака простаты.[22][23][24]
Рак печени
HIFU хорошо изучен при раке печени, и во многих исследованиях сообщается о высоком уровне ответа и положительных результатах для пациентов.[25]
Абскопальный эффект
Во время лечения метастазирующего рака печени с помощью HIFU иммунные ответы наблюдались в местах, удаленных от очаговой области.[26] Хотя механизм этого системного ответа неизвестен, считается, что он вызывается высвобождением опухолевых антигенов с сохраненной иммуногенностью посредством гистотрипсии.[27]
Другие виды рака
HIFU успешно применяется в лечение рака для разрушения солидных опухолей костей, головного мозга, груди, поджелудочной железы, прямой кишки, почек, яичек, простаты.[28]
Паллиативная помощь
Было обнаружено, что HIFU оказывает паллиативный эффект. Сертификат CE был назначен для паллиативного лечения костный метастаз.[29] Экспериментально обнаружен паллиативный эффект при запущенных панкреатический рак.[30]
Увеличение простаты
Лечение увеличения простаты (доброкачественная гиперплазия предстательной железы ) по HIFU изнутри кишечник (трансректальный) оказался безуспешным.[31][32]
В некоторых странах, за исключением США, HIFU также предлагается изнутри простаты, то есть через катетер в простатическая уретра. Доказательств по состоянию на 2019 год нет.[33]
В Англии Национальный институт здравоохранения и передового опыта (NICE) в 2018 году классифицировал метод как «не рекомендуемый».[34] В США (по состоянию на 2019 год) не утверждено даже техническое устройство, необходимое для лечения.[35]
Механизм
Эта секция нужно больше медицинские справки за проверка или слишком сильно полагается на основные источники. (Апрель 2016 г.) |
Лучи HIFU точно фокусируются на небольшом участке пораженной ткани, чтобы локально выделять высокие уровни энергии.
Фокусирующий эффект датчика позволяет передавать высокое звуковое давление в точку фокусировки, не вызывая нежелательного повреждения других тканей. Это повышение давления может вызвать ряд эффектов, включая нагрев и кавитация.

- Источники ультразвука могут использоваться для создания регионального нагрева и механических изменений в биологической ткани, например в и лечение рака.
- Сфокусированный ультразвук можно использовать для создания высоко локализованного нагрева для лечения кист и опухолей (доброкачественных или злокачественных). Это известно как сфокусированный ультразвук с магнитным резонансом (MRgFUS) или сфокусированный ультразвук высокой интенсивности (HIFU). В этих процедурах обычно используются более низкие частоты, чем при медицинском диагностическом ультразвуке (от 0,250 до 2 МГц), но значительно более высокие энергии. Лечение HIFU часто руководствуется МРТ.
- Сфокусированный ультразвук можно использовать для разрушения камни в почках к литотрипсия.
- Ультразвук можно использовать для катаракта лечение факоэмульсификация.
В 2015 году FDA разрешило два устройства HIFU для абляции ткани простаты.[36]
Температура
Температура ткани в очаге повысится до 65-85 ° C, что приведет к разрушению пораженной ткани. коагуляционный некроз. Если температура ткани превышает пороговое значение 60 ° C более 1 секунды, этот процесс необратим.[37] Обычно избегают более высоких температур, чтобы предотвратить кипение жидкости внутри ткани. Каждый обработка ультразвуком (индивидуальное воздействие ультразвуковой энергии) воздействует на точно определенный участок ткани-мишени. Вся терапевтическая мишень обрабатывается с помощью нескольких ультразвуковых обработок для создания объема обработанной ткани в соответствии с протоколом, разработанным врачом. Анестезия не требуется, но обычно рекомендуется седация.[38]
Количество повреждений, нанесенных ткани, можно смоделировать с помощью кумулятивного эквивалента минут (CEM). За прошедшие годы было предложено несколько формулировок уравнения CEM, но уравнение, используемое в настоящее время для большинства исследований, проводимых в HIFU-терапии, взято из статьи Дьюи и Сапарето 1984 года:[39]
с интегралом по времени обработки, R = 0,5 для температур выше 43 ° C и 0,25 для температур от 43 ° C до 37 ° C, эталонная температура 43 ° C и время в минутах. Эта формула представляет собой эмпирическую формулу, полученную в результате экспериментов, проведенных Дьюи и Сапарето путем измерения выживаемости клеточных культур после воздействия тепла.[40]
Когда акустическая волна распространяется через ткань, часть ее поглощается и преобразуется в тепло. С помощью сфокусированных лучей можно достичь очень небольшой области нагрева глубоко в тканях (обычно порядка миллиметров). Повреждение ткани зависит как от температуры, до которой нагревается ткань, так и от того, как долго ткань подвергается воздействию этого уровня тепла в метрике, называемой «тепловой дозой». Путем фокусировки более чем в одном месте или сканирования фокуса объем можно подвергнуть термической абляции.[41][42][43] Температурные дозы 120–240 мин при 43 ° С коагулируют клеточный белок и приводят к необратимому разрушению тканей.
Есть некоторые свидетельства того, что HIFU можно применять при раковых заболеваниях, чтобы нарушить микросреда опухоли и вызвать иммунный ответ, а также, возможно, повысить эффективность иммунотерапии.[44][45]
Механический
Промежуточная кавитация
При достаточно высокой акустической интенсивности кавитация (образуются микропузырьки и взаимодействуют с ультразвуковым полем). Микропузырьки, образующиеся в поле, колеблются и растут (из-за факторов, в том числе выпрямленных распространение ), и в конечном итоге может взорваться (инерционная или переходная кавитация). Во время инерционной кавитации внутри пузырьков возникают очень высокие температуры, и схлопывание во время фазы разрежения связано с ударная волна и форсунки, которые могут механически повредить ткани.[46]
Стабильная кавитация
Стабильная кавитация создает микропоток, который вызывает высокие силы сдвига и приводит к апоптозу. Более того, пузырьки, образующиеся при испарении воды из-за акустических сил, колеблются под акустическим полем низкого давления. Сильный поток может вызвать повреждение клеток, но также снижает температуру ткани за счет конвективной потери тепла.[47]
Теория
Есть несколько способов фокус ультразвук - через линзу (например, полистирол линза), изогнутая преобразователь, а фазированная решетка, или любую их комбинацию. Это концентрирует его в небольшой фокусной зоне; это похоже на концепцию фокусировки света через увеличительное стекло. Это можно определить с помощью экспоненциальной модели затухание ультразвука. Профиль интенсивности ультразвука ограничен экспоненциально убывающей функцией, где уменьшение ультразвука является функцией расстояния, пройденного через ткань:
- начальная интенсивность пучка, это коэффициент затухания (в единицах обратной длины), а z - расстояние, пройденное через затухающую среду (например, ткань).
В этой модели [48] является мерой удельная мощность тепла, поглощенного ультразвуковым полем. Иногда SAR также используется для выражения количества тепла, поглощаемого конкретной средой, и получается путем деления Q на плотность ткани. Это демонстрирует, что нагрев ткани пропорционален интенсивности, и эта интенсивность обратно пропорциональна площади, по которой распространяется ультразвуковой луч, поэтому фокусировка луча в острой точке (т.е. увеличение интенсивности луча) приводит к быстрому повышению температуры в фокус.[нужна цитата ]
Ультразвуковой луч можно сфокусировать следующими способами:
- Геометрически, например, с линза или со сферически изогнутым преобразователь.
- Электронным способом, регулируя относительные фазы элементов в матрице преобразователей ("фазированная решетка "). Динамически подстраивая электронные сигналы к элементам фазированной решетки, луч может быть направлен в различные места, а аберрации ультразвукового луча, вызванные тканевыми структурами, могут быть исправлены.[нужна цитата ]
Доставка луча
Доставка луча состоит из управления лучом и управления изображением. Луч имеет способность проходить через вышележащие ткани без вреда и фокусироваться на локализованном участке размером 3–4 см.[49] Область в фокусе луча подвергается коагуляционному некрозу. После абляции между здоровой и некротической тканью образуется четкая граница (ширина менее 50 мкм).[49]
Управление лучом
Чаще всего используется вогнутый фокусирующий преобразователь с фиксированной апертурой и фиксированным фокусным расстоянием.[49] Преобразователи с фазированной решеткой также могут использоваться в различных схемах (плоская / чаша).[49]
Руководство по изображению
HIFU-терапия требует тщательного наблюдения и обычно проводится в сочетании с другими методами визуализации.
Например, предоперационная визуализация CT и МРТ, обычно используются для определения общих параметров целевой анатомии. С другой стороны, визуализация в реальном времени необходима для безопасного и точного неинвазивного нацеливания и мониторинга терапии. И МРТ, и Медицинское УЗИ визуализация использовалась для руководства при лечении FUS. Эти методы известны как сфокусированная ультразвуковая хирургия под магнитно-резонансным контролем (MRgFUS).[50] и фокусированная ультразвуковая хирургия под контролем ультразвука (USgFUS) соответственно.[1][51] MRgFUS - это метод трехмерной визуализации, который отличается высоким контрастом мягких тканей и предоставляет информацию о температуре, что позволяет контролировать абляцию. Однако из-за низкой частоты кадров этот метод плохо работает при построении изображений в реальном времени, а высокая стоимость представляет собой существенное ограничение для его использования.[52] Иными словами, USgFUS - это метод 2D-визуализации, в котором, хотя до сих пор не было коммерческой разработки системы для предоставления количественной информации о температуре, используются несколько преимуществ, например высокая частота кадров (до 1000 изображений в секунду), низкая стоимость и минимальное вредное воздействие на здоровье. Еще одна причина, по которой ультразвук идеально подходит для визуализации, заключается в том, что он проверяет акустическое окно в реальном времени, поскольку это тот же метод, что и терапия.[53] Смысл этого заключается в том, что если целевая область не визуализируется ультразвуковой визуализацией до и во время HIFU-терапии, то маловероятно, что HIFU-терапия будет эффективной в этой конкретной области.[53] Кроме того, результаты лечения могут быть оценены в режиме реального времени путем визуального осмотра гиперэхогенных изменений на стандартных изображениях в B-режиме.[2]
Рекомендации
- ^ а б c Дубинский, Теодор Дж .; Куэвас, Карлос; Dighe, Manjiri K .; Колокитас, Орфей; Хван, Джу Ха (2008). «Сфокусированный ультразвук высокой интенсивности: современные возможности и онкологические приложения». Американский журнал рентгенологии. 190 (1): 191–199. Дои:10.2214 / AJR.07.2671. ISSN 0361-803X. PMID 18094311.
- ^ а б Ebbini, Emad S .; Тер Хаар, Гейл (2015). «Терапевтический фокусированный ультразвук под контролем ультразвука: текущее состояние и будущие направления». Международный журнал гипертермии. 31 (2): 77–89. Дои:10.3109/02656736.2014.995238. ISSN 0265-6736. PMID 25614047. S2CID 23590340.
- ^ Гелет, А; Мюрат, Франсуа-Жозеф; Пуассонье, L (2007). «Рецидив рака простаты после лучевой терапии - спасительное лечение с помощью фокусированного ультразвука высокой интенсивности». Европейское онкологическое заболевание. 1 (1): 60–2.
- ^ УШИФУ (2012). «Клиническая информация о HIFU в США». Архивировано из оригинал 7 августа 2009 г.
- ^ Hynynen, K .; Damianou, C .; Дарказанлы, А .; Unger, E .; Леви, М .; Шенк, Дж. Ф. (1992). «Неинвазивная ультразвуковая хирургия под контролем МРТ». Труды ежегодной международной конференции общества инженеров IEEE в медицине и биологии: 350–351. Дои:10.1109 / IEMBS.1992.5760999. ISBN 978-0-7803-0785-8. S2CID 31185306.
- ^ США 5247935, "Магнитно-резонансная фокусированная ультразвуковая хирургия", выпущенная 19 марта 1992 г.
- ^ а б Одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов, система ExAblate® 2000 - P040003
- ^ Робертсон, VJ; Бейкер, KG (2001). «Обзор терапевтического ультразвука: исследования эффективности». Физиотерапия. 81 (7): 1339–50. Дои:10.1093 / ptj / 81.7.1339. PMID 11444997.
- ^ Элиас, У. Джеффри; Гус, Дайан; Восс, Тиффини; Лумба, Джоанна; Халед, Мохамад; Задикарио, Эял; Фрайзингер, Роберт С.; Sperling, Scott A .; Уайли, Скотт; Монтейт, Стивен Дж .; Друзгал, Ясон; Шах, Бинит Б .; Харрисон, Мадалин; Винтермарк, Макс (2013). «Экспериментальное исследование сфокусированной ультразвуковой таламотомии при эссенциальном треморе». Медицинский журнал Новой Англии. 369 (7): 640–8. Дои:10.1056 / NEJMoa1300962. PMID 23944301.
- ^ Жанмоно, Даниэль; Вернер, Бит; Морель, Энн; Михельс, Ларс; Задикарио, Эял; Шифф, Гилат; Мартин, Эрнст (2012). «Транскраниальная магнитно-резонансная томография под контролем сфокусированного ультразвука: неинвазивная центральная боковая таламотомия при хронической невропатической боли» (PDF). Нейрохирургия. 32 (1): E1. Дои:10.3171 / 2011.10.FOCUS11248. PMID 22208894.
- ^ Магара, Анук; Бюлер, Роберт; Мозер, Дэвид; Ковальский, Милек; Пуртехрани, Паям; Жанмоно, Даниэль (2014). «Первый опыт применения сфокусированного ультразвука под МРТ в лечении болезни Паркинсона». Журнал терапевтического ультразвука. 2: 11. Дои:10.1186/2050-5736-2-11. ЧВК 4266014. PMID 25512869.
- ^ Выпуск новостей FDA. «FDA одобрило первое устройство сфокусированного ультразвука под контролем МРТ для лечения эссенциального тремора», FDA, 11 июля 2016 г.
- ^ Мартин-Фиори, Э (2014). Интраоперационная визуализация и терапия под визуализацией. Нью-Йорк: Спрингер. Дои:10.1007/978-1-4614-7657-3_45. ISBN 978-1-4614-7657-3.
- ^ Феннесси, Фиона; Фишер, Кристина; Макданнольд, Натан; Jolesz, Ferenc; Темпани, Клэр (2015). «Возможности минимально инвазивных процедур при лечении миомы матки: фокус на магнитно-резонансной ультразвуковой терапии». Международный журнал женского здоровья. 7: 901–12. Дои:10.2147 / IJWH.S55564. ЧВК 4654554. PMID 26622192.
- ^ Стюарт, Элизабет А .; Gostout, Бобби; Рабиновичи, Ярон; Kim, Hyun S .; Риган, Лесли; Темпани, Клэр М. С. (2007). «Устойчивое облегчение симптомов лейомиомы с помощью фокусированной ультразвуковой хирургии». Акушерство и гинекология. 110 (2, часть 1): 279–87. Дои:10.1097 / 01.AOG.0000275283.39475.f6. PMID 17666601. S2CID 6650678.
- ^ Чжоу, Юйфэн (2014). «Фокусированное ультразвуковое лечение высокой интенсивности для запущенного рака поджелудочной железы». Гастроэнтерологические исследования и практика. 2014. Дои:10.1155/2014/205325. ISSN 1687-6121. ЧВК 4099025. PMID 25053938.
- ^ Jácome-Pita, F; Санчес-Салас, Р. Barret, E; Амарух, N; Gonzalez-Enguita, C; Кателинеу, X (2014). «Фокальная терапия при раке простаты: текущая ситуация». ракмедицина. 8: 435. Дои:10.3332 / ecancer.2014.435. ЧВК 4049329. PMID 24944577.
- ^ Диагностическое УЗИ (4-е изд.). Эльзевир. 2011. С. 32–33. ISBN 978-0-323-05397-6.
- ^ «FDA очищает сфокусированную ультразвуковую систему для лечения рака простаты». Онкология Times. 37 (22): 37. Ноябрь 2015. Дои:10.1097 / 01.COT.0000475249.19383.04.
- ^ «510 (k) Предварительное уведомление». www.accessdata.fda.gov.
- ^ «Письмо об утверждении классификации типа 2» (PDF).
- ^ Чаусси, CG; Thüroff, S (апрель 2017 г.). «Сфокусированный ультразвук высокой интенсивности для лечения рака простаты: обзор». Журнал эндоурологии. 31 (S1): S30 – S37. Дои:10.1089 / конец.2016.0548. PMID 28355119.
- ^ Ху, Джим С .; Лавиана, Аарон; Седракян, Искусство (28 июня 2016 г.). «Сфокусированный ультразвук высокой интенсивности для рака простаты». JAMA. 315 (24): 2659–60. Дои:10.1001 / jama.2016.5002. PMID 27367874.
- ^ Lepor, H; Золото, S; Wysock, J (2018). «Фокальная абляция рака простаты». Отзывы в урологии. 20 (4): 145–157. Дои:10.3909 / riu0809 (неактивно 08.11.2020). ЧВК 6375006. PMID 30787673.CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
- ^ Ng, Kelvin K. C .; Пун, Ронни Т. П .; Чан, см. Цзин; Chok, Kenneth S.H .; Чунг, Тан То; Тунг, Хелен; Чу, Фердинанд; Цо, Вай Куэн; Ю, Ван Чинг; Ло, Чунг Мау; Фан, Шеунг Тат (май 2011 г.). «Сфокусированный ультразвук высокой интенсивности для гепатоцеллюлярной карциномы: опыт одного центра». Анналы хирургии. 253 (5): 981–987. Дои:10.1097 / SLA.0b013e3182128a8b. ISSN 1528-1140. PMID 21394012.
- ^ Маури, Джованни; Никосия, Лука; Сюй, Чжэнь; Ди Пьетро, Сальваторе; Монфардини, Лоренцо; Бономо, Гвидо; Варано, Джанлука Мария; Прада, Франческо; Делла Винья, Паоло; Орси, Франко (март 2018 г.). «Сфокусированный ультразвук: удаление опухоли и ее потенциал для усиления иммунологической терапии рака». Британский журнал радиологии. 91 (1083). Дои:10.1259 / bjr.20170641. ISSN 0007-1285. ЧВК 5965486. PMID 29168922.
- ^ Цюй, Шибин; Ворликар, Теджасви; Фелстед, Эми Э .; Гангули, Анутош; Бимс, Меган В .; Хаббард, Райан; Пеппл, Эшли Л .; Кевелин, Алисия А .; Гаравалья, Ханна; Диб, Джо; Тома, Мариам (01.01.2020). «Удаление опухоли с помощью нетепловой гистотрипсии способствует развитию иммунного ответа, который усиливает иммунотерапию рака». Журнал иммунотерапии рака. 8 (1): e000200. Дои:10.1136 / jitc-2019-000200. ISSN 2051-1426. PMID 31940590.
- ^ Терапевтический ультразвук. Успехи экспериментальной медицины и биологии. Нью-Йорк: Спрингер. 2016 г. ISBN 978-3-319-22536-4.
- ^ «Philips Sonalleve получает знак CE за фокусированную ультразвуковую абляцию метастатического рака кости под контролем МРТ» (Пресс-релиз). Philips Healthcare. 20 апреля 2011 г. Архивировано с оригинал 5 октября 2013 г.. Получено 4 октября, 2013.
- ^ Wu, F .; Wang, Z.-B .; Zhu, H .; Chen, W.-Z .; Zou, J.-Z .; Bai, J .; Li, K.-Q .; Jin, C.-B .; Xie, F.-L .; Су, Х.-Б. (2005). «Выполнимость высокоинтенсивного сфокусированного ультразвукового лечения под контролем УЗИ у пациентов с распространенным раком поджелудочной железы: начальный опыт». Радиология. 236 (3): 1034–40. Дои:10.1148 / радиол.2362041105. PMID 16055692.
- ^ Madersbacher S, Schatzl G, Djavan B, Stulnig T, Marberger M (2000). «Отдаленный результат трансректальной высокоинтенсивной фокусированной ультразвуковой терапии доброкачественной гиперплазии предстательной железы». Eur Urol. 37 (6): 687–94. Дои:10.1159/000020219. PMID 10828669. S2CID 46793601.CS1 maint: несколько имен: список авторов (связь)
- ^ Соммер Дж., Поли КБ, Холбрук А., Плата Дж., Даниэль Б., Були Д. (2013). «Аппликаторы для ультразвуковой абляции доброкачественной гиперплазии предстательной железы под магнитным резонансом». Инвест Радиол. 48 (6): 387–94. Дои:10.1097 / RLI.0b013e31827fe91e. ЧВК 4045500. PMID 23462673.CS1 maint: несколько имен: список авторов (связь)
- ^ Салгаонкар В.А., Дидерих С.Дж. (2015). «Катетерная ультразвуковая технология для тепловой терапии под визуальным контролем: современные технологии и приложения». Int J Hyperth. 31 (2): 203–15. Дои:10.3109/02656736.2015.1006269. ЧВК 4659534. PMID 25799287.
- ^ Национальный институт здравоохранения и передового опыта (ОТЛИЧНО): Текущий путь лечения (для ДГПЖ), Август 2018.
- ^ Основа для сфокусированного ультразвука: Доброкачественная гиперплазия предстательной железы (ДГПЖ), Сайт PR-организации отрасли.
- ^ http://www.accessdata.fda.gov/cdrh_docs/pdf15/DEN150011.pdf[требуется полная цитата ][постоянная мертвая ссылка ]
- ^ Чжоу Юй-Фэн (10.01.2011). «Сфокусированный ультразвук высокой интенсивности в клинической абляции опухоли». Всемирный журнал клинической онкологии. 2 (1): 8–27. Дои:10.5306 / wjco.v2.i1.8. ISSN 2218-4333. ЧВК 3095464. PMID 21603311.
- ^ Терапевтический ультразвук. Успехи экспериментальной медицины и биологии. Нью-Йорк: Спрингер. 2016. С. 3–20. ISBN 978-3-319-22536-4.
- ^ Сапарето, Стивен А .; Дьюи, Уильям К. (1984). «Определение тепловой дозы в терапии рака». Международный журнал радиационной онкологии, биологии, физики. 10 (6): 787–800. Дои:10.1016/0360-3016(84)90379-1. PMID 6547421.
- ^ Mouratidis, Petros X. E .; Ривенс, Ян; Сивале, Джон; Саймондс-Тайлер, Ричард; Хаар, Гейл тер (01.01.2019). "'Взаимосвязь между тепловой дозой и гибелью клеток для «быстрого» абляционного и «медленного» гипертермического нагрева'". Международный журнал гипертермии. 36 (1): 228–242. Дои:10.1080/02656736.2018.1558289. ISSN 0265-6736. PMID 30700171.
- ^ Huisman, Merel; Лам, Ми К; Бартельс, Ламбертус В; Nijenhuis, Robbert J; Moonen, Chrit T; Knuttel, Этаж M; Verkooijen, Helena M; ван Вулпен, Марко; ван ден Бош, Морис А (2014). «Возможность применения объемного сфокусированного ультразвука высокой интенсивности под контролем МРТ (MR-HIFU) для болезненных метастазов в кости». Журнал терапевтического ультразвука. 2: 16. Дои:10.1186/2050-5736-2-16. ЧВК 4193684. PMID 25309743.
- ^ Köhler, Max O .; Мужено, Шарль; Квессон, Бруно; Энхольм, Джулия; Ле Бейл, Бриджит; Лоран, Кристоф; Moonen, Chrit T. W .; Ehnholm, Gösta J. (2009). «Объемная HIFU-абляция под 3D контролем быстрой МРТ-термометрии». Медицинская физика. 36 (8): 3521–35. Bibcode:2009МедФ..36.3521К. Дои:10.1118/1.3152112. PMID 19746786.
- ^ Монтейт, Стивен Дж .; Kassell, Neal F .; Горен, Одед; Харноф, Саги (2013). «Транскраниальный ультразвуковой сонотромболизис под контролем МРТ в лечении внутримозговых кровоизлияний». Нейрохирургия. 34 (5): E14. Дои:10.3171 / 2013.2.FOCUS1313. PMID 23634918.
- ^ Haen, Sebastian P .; Pereira, Philippe L .; Salih, Helmut R .; Раммензее, Ханс-Георг; Gouttefangeas, Сесиль (2011). «Больше, чем просто разрушение опухоли: иммуномодуляция посредством термической абляции рака». Клиническая иммунология и иммунология развития. 2011: 1–19. Дои:10.1155/2011/160250. ЧВК 3254009. PMID 22242035.
- ^ Ву, Фэн (2013). «Фокусированная ультразвуковая абляция высокой интенсивности и противоопухолевый иммунный ответ». Журнал акустического общества Америки. 134 (2): 1695–701. Bibcode:2013ASAJ..134.1695W. Дои:10.1121/1.4812893. PMID 23927210.
- ^ Лейтон, Т. (1997). Ультразвук в пищевой промышленности. Глава 9: Принципы кавитации: Thomson Science, Лондон, Blackie Academic and Professional. С. 151–182.CS1 maint: location (связь)
- ^ Леварио-Диас, Виктория; Бхаскар, Прадип; Кармен Галан, М .; Барнс, Адриан К. (22 мая 2020 г.). «Влияние акустических стоячих волн на жизнеспособность клеток и метаболическую активность». Научные отчеты. 10 (1): 8493. Дои:10.1038 / s41598-020-65241-4. ISSN 2045-2322.
- ^ Hariharan, P; Майерс, М. Р.; Банерджи, Р. К. (21 июля 2007 г.). «Процедуры HIFU средней интенсивности - влияние крупных сосудов». Физика в медицине и биологии. 52 (12): 3493–3513. Bibcode:2007PMB .... 52.3493H. Дои:10.1088/0031-9155/52/12/011. PMID 17664556. S2CID 26124121.
- ^ а б c d Изадифар, Захра; Изадифар, Зохре; Чепмен, декан; Бабин, Пол (07.02.2020). «Введение в сфокусированный ультразвук высокой интенсивности: систематический обзор принципов, устройств и клинических применений». Журнал клинической медицины. 9 (2). Дои:10.3390 / см 9020460. ISSN 2077-0383. ЧВК 7073974. PMID 32046072.
- ^ Медель, Рики; Монтейт, Стивен Дж .; Элиас, У. Джеффри; Имс, Мэтью; Снелл, Джон; Sheehan, Джейсон П .; Винтермарк, Макс; Jolesz, Ferenc A .; Касселл, Нил Ф. (2012). «Магнитно-резонансная фокусированная ультразвуковая хирургия». Нейрохирургия. 71 (4): 755–763. Дои:10.1227 / NEU.0b013e3182672ac9. ISSN 0148-396X. ЧВК 4104674. PMID 22791029.
- ^ Бельцберг, Мика; Махапатра, смрути; Пердомо-Пантоя, Александр; Чавес, Франсиско; Моррисон, Кайл; Xiong, K. Timothy; Gamo, Nao J .; Рестайно, Стивен А .; Такор, Нитиш; Язди, Юсеф; Айер, Раджив; Тайлер, Бетти; Феодор, Николай; Лучано, Марк Дж .; Брем, Генри; Гровс, Мари; Коэн, Алан Р .; Манбачи, Амир (2020). «Минимально инвазивный терапевтический ультразвук: ультразвуковая абляция под ультразвуковым контролем в нейроонкологии». Ультразвук. 108 (12): 106210. Дои:10.1016 / j.ultras.2020.106210. PMID 32619834.
- ^ Cafarelli, A .; Мура, М .; Diodato, A .; Schiappacasse, A .; Санторо, М .; Ciuti, G .; Менсиасси, А. (2015). «Компьютерная роботизированная платформа для фокусированной ультразвуковой хирургии: оценка доставки фокусированного ультразвука высокой интенсивности». 2015 37-я ежегодная международная конференция общества инженеров IEEE в медицине и биологии (EMBC). 2015. С. 1311–1314. Дои:10.1109 / EMBC.2015.7318609. ISBN 978-1-4244-9271-8. PMID 26736509. S2CID 4194253.
- ^ а б Чен, По-Хэн; Се, Кай-Шэн; Хуанг, Чжи-Чжун (2017). «Метод акустического отслеживания для имитатора ультразвуковых изображений в медицине». Журнал медицинской и биологической инженерии. 37 (6): 944–952. Дои:10.1007 / s40846-017-0258-9. ISSN 1609-0985. ЧВК 6208925. PMID 30416414.
внешняя ссылка
- Терапевтический ультразвук в Керли
- Несмотря на сомнения, лечение рака привлекает пациентов из Нью-Йорк Таймс на 18





