Реакция Имина Дильса – Альдера - Imine Diels–Alder reaction
В я добываю Реакция Дильса – Альдера предполагает преобразование полностью углеродного диены и иминдиенофилы в тетрагидропиридины.[1]
Вступление
Imines могут использоваться в качестве диенофилов в гетеро-реакциях Дильса-Альдера. В этих реакциях участвует самая низкая незанятая молекулярная орбиталь (LUMO ) имина, что означает, что имин замещен на электроноакцепторные группы по азоту являются наиболее реактивными. Реакция может быть термической, в рефлюкс растворители, такие как бензол или другие, характерные для реакций Дильса – Альдера, или кислотный катализатор, опять же с использованием обычного Дильса – Альдера Кислоты Льюиса Такие как трифторид бора или же хлорид цинка. Он может протекать через согласованный механизм [4 + 2] циклоприсоединения, хотя в случаях крайней поляризации происходит добавление к имину с последующей нуклеофильной атакой азота (путь «Манниха-Михаэля»).[2] Циклические, ациклические и связанные имины все успешно применялись в реакции.
(1)

Простой алкил или же арил амины часто образуются на месте путем объединения гидрохлорида амина с альдегидом.
Механизм и стереохимия
Преобладающий механизм
Имино-реакция Дильса-Альдера (IDA) может протекать как согласованным, так и ступенчатым способом. Состояние перехода с самой низкой энергией для согласованного процесса помещает неподеленную пару имина (или координированную кислоту Льюиса) в экзопозиция. Таким образом, (E) имины, в которых неподеленная пара и более крупный имин-углеродный заместитель являются СНГ, как правило, дают экзо товары.[3]
(2)

Когда иминный азот протонируется или координируется с сильной кислотой Льюиса, механизм переходит на ступенчатый путь Манниха-Майкла.[4]
(3)
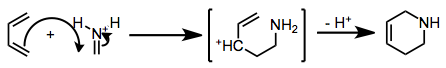
Каким бы ни был механизм, переходное состояние циклизации сильно поляризовано. Таким образом, региохимию циклоприсоединения можно предсказать, учитывая электроноакцепторную или донорную природу заместителей в диене. Углерод, имеющий наибольший коэффициент в ВЗМО диена, образует связь с иминным углеродом.
(4)

Стереоселективные варианты
Во многих случаях циклические диены обладают более высокой диастереоселективностью, чем ациклические диены. Использование хиральных вспомогательных веществ на основе аминокислот, например, приводит к хорошей диастереоселективности в реакциях циклопентадиена, но не в реакциях ациклических диенов.[5]
(6)

Хиральные вспомогательные вещества использовались либо для имино-азота[6] или имино углерод[7] для осуществления диастереовыбора.
(5)

Объем и ограничения
Присоединение электроноакцепторной группы к иминному азоту увеличивает реакционную способность имина. В экзо изомер обычно преобладает (особенно при использовании циклических диенов), хотя селективность варьируется.[8]
(7)

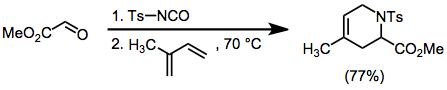
Тозилимины могут образовываться на месте из тозилизоцианата и альдегидов. Циклоприсоединение этих промежуточных продуктов к диенам дает единичные структурные изомеры, но протекает с умеренной стереоселективностью.[9]
(8)
Катализируемые кислотой Льюиса реакции сульфонилиминов также демонстрируют умеренную стереоселективность.[10]
(9)

Простые неактивированные имины реагируют с углеводородными диенами только с помощью кислоты Льюиса; тем не менее, как богатые электронами, так и бедные электронами диены при нагревании реагируют с неактивированными иминами. Винилкетены, например, дают дигидропиридоны при [4 + 2] циклоприсоединении с иминами. Регио- и стереоселективность в реакциях этого класса диенов необычно высоки.[11]
(10)

Винилаллены реагируют аналогичным образом в присутствии кислоты Льюиса, часто с высокой диастереоселективностью.[12]
(11)

Синтетические приложения
Реакция IDA была применена для синтеза ряда природных алкалоидных продуктов. В этом примере диен Данишефского используется для образования шестичленного кольца на пути к филлантину.[13]
(12)

Сравнение с другими методами
Некоторые другие методы могут получить доступ к 1,2,5,6-тетрагидропиридиновой кольцевой системе, полученной в результате реакций IDA. Было использовано частичное восстановление солей пиридиния, хотя проблемы региоселективности возникают при использовании замещенных пиридиний.[14]
(13)

Модифицированная перегруппировка Ирландии-Клейзена приводит к тетрагидропиридинам через промежуточное соединение силилкетенацеталь.[15]
(14)

Метатезис олефинов с замыканием цикла также использовался для установления тетрагидропиридиновой кольцевой системы.[16]
(15)

Смотрите также
Рекомендации
- ^ Heintzelman, G.R .; Meigh, I.R .; Махаджан, Ю. Р .; Вайнреб, С. М. (2005). "Реакции Дильса-Альдера имино диенофилов". Орг. Реагировать. 65: 141–599. Дои:10.1002 / 0471264180.or065.02. ISBN 0471264180.
- ^ Вальдманн, Х. (1994). «Асимметричные гетеро реакции Дильса-Альдера». Синтез. 1994 (6): 535–551. Дои:10.1055 / с-1994-25519.
- ^ Whiting, A .; Виндзор, К. М. (1998). «Что заставляет нейтральный имино-диенеофил подвергнуться термической, некаталитической реакции Дильса-Альдера?». Тетраэдр. 54 (22): 6035. Дои:10.1016 / S0040-4020 (98) 00284-1.
- ^ Эрмитаж, С .; Джей, Д. А .; Уайтинг, А. (2002). «Доказательства несогласованного 4 + 2] -циклоприсоединения N-арилиминов при действии как диенофилов, так и диенов в условиях, катализируемых кислотой Льюиса». Tetrahedron Lett. 43 (52): 9633. Дои:10.1016 / S0040-4039 (02) 02392-4.
- ^ Вальдманн, Х. (1989). "Asymmetrische Hetero-Diels-Alder-Reaktionen в wäßriger Lösung unter Verwendung von Aminosäureestern als chiralen Auxiliaren". Liebigs Ann. Chem. 1989 (3): 231–238. Дои:10.1002 / jlac.198919890145.
- ^ Hedberg, C .; Pinho, P .; Roth, P .; Андерссон, П. Г. (2000). «Реакция Дильса-Альдера гетероциклических иминдиенофилов». J. Org. Chem. 65 (9): 2810–2. Дои:10.1021 / jo9916683. PMID 10808461.
- ^ Ишимару, К .; Watanabe, K .; Yamamoto, Y .; Акиба, К.-Ю. (1994). «Стереоконтроль в 4 + 2] типе циклоприсоединения альдимина, полученного из (S) -этиллактата, с 2-силокси-1,3-бутадиенами». Synlett. 1994 (7): 495. Дои:10.1055 / с-1994-22902.
- ^ Кори, Э. Дж .; Yuen, P.-W. (1989). «Короткий стереоспецифический путь к хиральным транс-2,6-дизамещенным хинуклидинам». Tetrahedron Lett. 30 (43): 5825. Дои:10.1016 / S0040-4039 (01) 93481-1.
- ^ Schrader, T .; Стеглич, В. (1990). "Phosphoranaloge von Aminosäuren IV.1Synthesen ungewöhnlicher 1-Aminophosphonsäuren über Diels-Alder-Reaktionen von (N-Acyliminomethyl) phosphonsäurediethylestern". Синтез. 1990 (12): 1153. Дои:10.1055 / с-1990-27122.
- ^ Krow, G. R .; Pyun, C .; Rodebaugh, R .; Мараковский, Дж. (1974). «Гетеродиенофилы - V». Тетраэдр. 30 (17): 2977. Дои:10.1016 / S0040-4020 (01) 97542-8.
- ^ Bennett, D.M .; Окамото, I .; Данхайзер, Р. Л. (1999). «Гетеро 4 + 2 циклоприсоединения (триалкилсилил) винилкетенов. Синтез альфа, бета-ненасыщенных дельта-валеролактонов и -лактамов». Орг. Латыш. 1 (4): 641–4. Дои:10.1021 / ol9907217. PMID 10823193.
- ^ Regas, D .; Афонсу, М. М .; Rodriguez, M. L .; Паленсуэла, Дж. А. (2003). «Синтез октагидрохинолинов посредством реакции винилалленов и иминов, катализируемой кислотой Льюиса». J. Org. Chem. 68 (20): 7845–52. Дои:10.1021 / jo034480z. PMID 14510565.
- ^ Вешать.; LaPorte, M. G .; Folmer, J. J .; Вернер, К. М .; Вайнреб, С. М. (2000). «Полный синтез алкалоидов Securinega (+) - 14,15-дигидронорсекуринина, (-) - норсекуринина и филлантина». J. Org. Chem. 65 (20): 6293–306. Дои:10.1021 / jo000260z. PMID 11052071.
- ^ Thyagarajan, G .; Мэй, Э. Л. (1971). «Улучшенный синтез 2-бензил-1,2,5,6-тетрагидропиридинов, предшественников анальгетических 6,7-бензоморфанов». J. Heterocycl. Chem. 8 (3): 465. Дои:10.1002 / jhet.5570080317.
- ^ Угол, S. R .; Генри, Р. М. (1998). «Исследования по синтезу (+) - палюстрама: первый асимметричный синтез (-) - метилпалустрамата». J. Org. Chem. 63 (21): 7490–7497. Дои:10.1021 / jo980749g. PMID 11672402.
- ^ Deiters, A .; Мартин, С. Ф. (2004). «Синтез кислород- и азотсодержащих гетероциклов метатезисом с замыканием цикла». Chem. Rev. 104 (5): 2199–238. Дои:10.1021 / cr0200872. PMID 15137789.
